I grassi del latte
Le recenti evidenze scientifiche hanno rivalutato i grassi del latte. Ecco cosa sapere.
SOMMARIO USCITA 98:
- Le raccomandazioni nutrizionali
- I grassi del latte
- Le proprietà dei grassi del latte: conclusioni
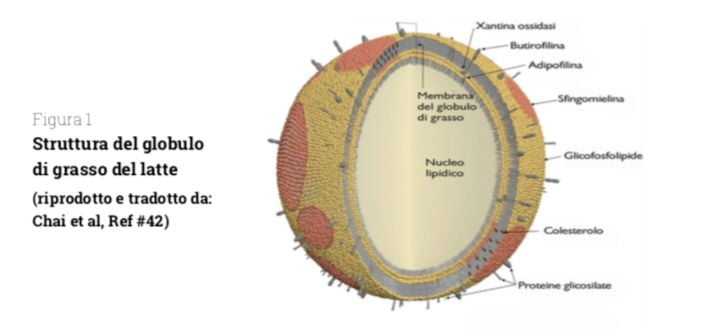
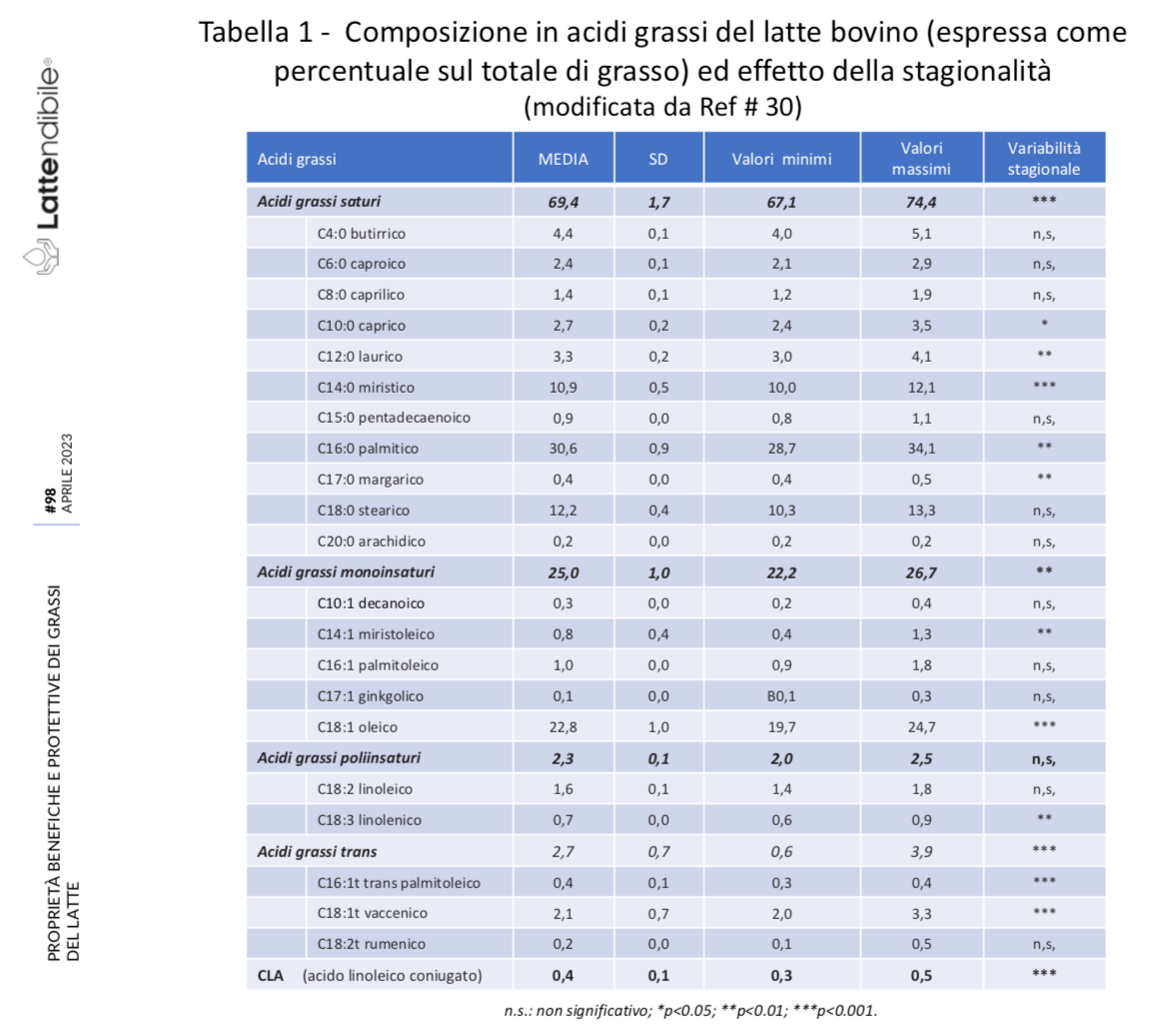
Il latte, infatti, è una delle fonti di grassi alimentari più complesse sia in termini di composizione di acidi grassi (Tabella 1), sia di struttura dei trigliceridi, sia anche come ultrastruttura, cioè per le proprietà fisico-chimiche della loro complessa struttura (Figura 1).
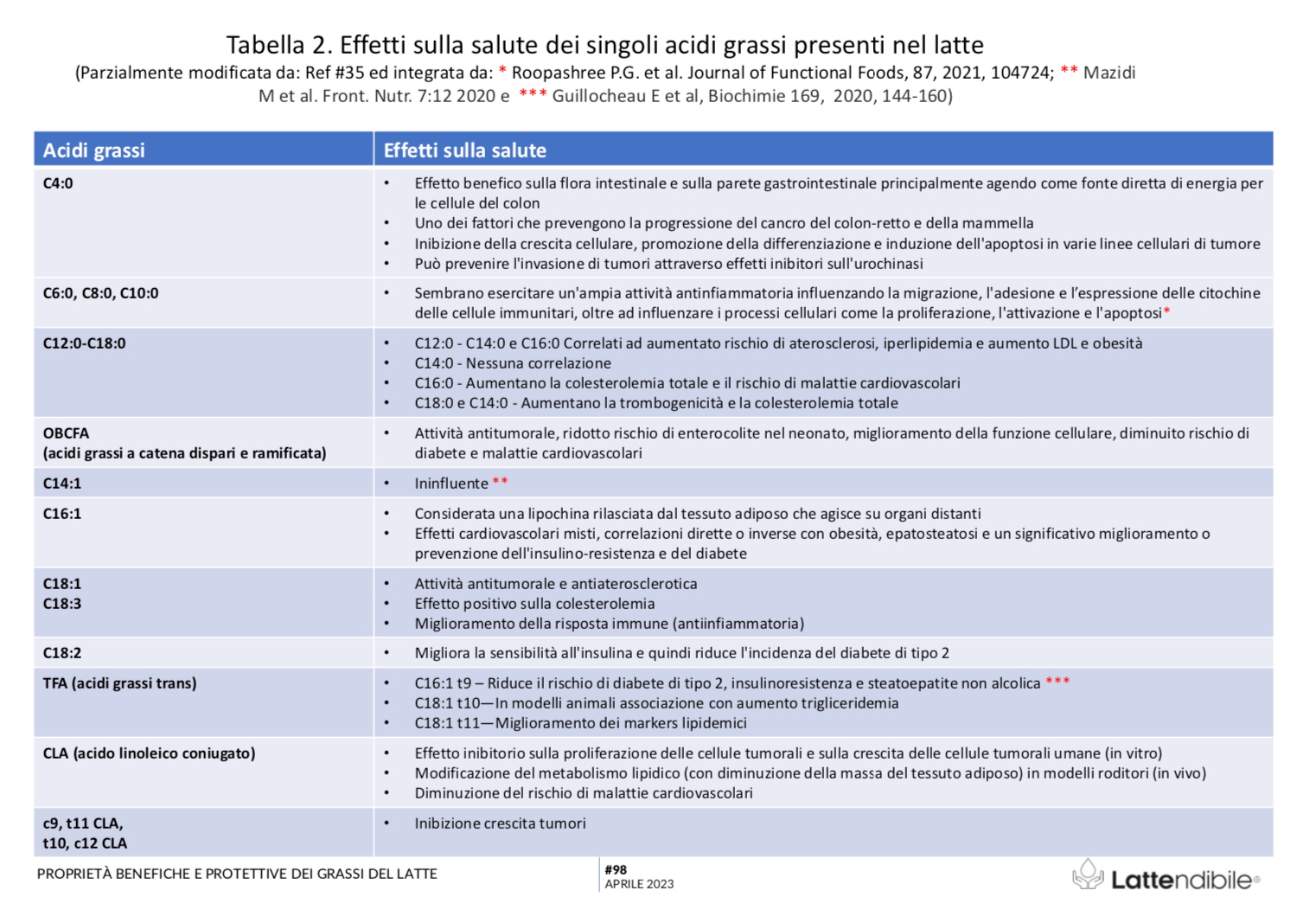
Parlando in termini quantitativi, gli acidi grassi saturi rappresentano certamente la quota maggiore di grassi (60-70%), ma gli acidi grassi insaturi (30-35%) sono principalmente monoinsaturi. Quindi, mentre da una parte ci si aspetta che gli acidi grassi saturi e il colesterolo possano contribuire al rischio cardiovascolare, dall’altra i grassi monoinsaturi ed altri componenti specifici del latte, come l’acido linoleico coniugato (CLA), la sfingomielina, gli acidi grassi saturi a catena dispari e l’acido butirrico sono dotate di interessanti proprietà antiaterogeniche, ma anche antitumorali (31-35), illustrate in Tabella 2.
Inoltre, sempre quantitativamente parlando, il grasso del latte ha una proprietà unica tra tutte le fonti di grassi: una buona parte dei saturi (circa il 20-25%, vedi Tabella 1) è a catena corta e media (SCFA, MCFA), con una digestione più rapida e facile e un’ossidazione più veloce, di cui si parlerà tra breve (36).
Tuttavia, oltre alla composizione quali-quantitativa in acidi grassi ed altre sostanze, dobbiamo tenere in considerazione anche come questi grassi sono organizzati all’interno dell’alimento latte, vale a dire la complessità strutturale dei grassi, presenti principalmente sotto forma di globuli di grasso (Figura 1).
Infatti, per avere un’idea della complessità della frazione lipidica del latte, che tra tutti gli alimenti naturali è la più complessa, possiamo considerare che i suoi trigliceridi sono costituiti da più di 400 diversi acidi grassi (37-39), posizionati in specifiche posizioni della cui importanza si parlerà in seguito.
La maggior parte di questi acidi grassi sono presenti solo in tracce non significative, ma una quindicina di questi raggiunge una concentrazione nutrizionalmente interessante (Tabella 1); la Tabella 2 riporta invece gli effetti sulla salute riconosciuti dei singoli componenti.
L’effetto complessivo sulla salute, però, sulla colesterolemia e sulle lipoproteine plasmatiche non è quello che ci si potrebbe aspettare sulla base della semplice composizione in acidi grassi.
L’aspetto più interessante del grasso del latte è infatti la sua ultrastruttura, cioè il modo in cui i trigliceridi vengono “organizzati”, in un’emulsione “olio-in-acqua”, in globuli di grasso di vario diametro (da 0,1 a 15 μm nel latte nativo che diventano inferiori ai 2 µm dopo omogeneizzazione), circondati e stabilizzati da una membrana a tre strati, che svolge interessanti proprietà nutritive ed è costituita da una parte grassa di lipidi polari (fosfolipidi, colesterolo, cerebrosidi tra i quali la sfingomielina) e per la parte magra da proteine soprattutto glicoproteine tra le quali mucina 1 e 15, butirofilina, PAS 6 e 7 e diversi enzimi, tra cui xantina ossidasi (40, 41) e rappresenta circa il 2-6% della massa del globulo (Figura 1).
All’interno di questa membrana è contenuto il nucleo dei globuli, costituito per il 98% da trigliceridi e per il restante 2% da digliceridi, colesterolo e acidi grassi liberi, più una certa quantità di eteri lipidici, idrocarburi, vitamine liposolubili, composti aromatici e altri composti lipofili introdotti dal mangime (37).
Ci sono crescenti evidenze che correlano i lipidi polari della dieta con un minore assorbimento intestinale di colesterolo, di trigliceridi e di acidi grassi, una diminuzione della colesterolemia non HDL, una modulazione del microbiota intestinale con riduzione della disbiosi e della permeabilità intestinale ed esercita effetti antiinfiammatori, antilipidemici e antiaterosclerotici (42-45), quindi tutte azioni estremamente importanti per la salute, mediate dalla parte grassa del latte.
Ma non basta. Gli acidi grassi non sono casualmente esterificati nelle tre posizioni stereochimiche della molecola dei trigliceridi (5), ma gli acidi a catena corta, butirrico e caproico sono esterificati interamente in sn-3, mentre gli acidi grassi a catena media (8:0-14:0) e lunga (16:0) sono preferenzialmente esterificati nelle posizioni sn-1 e sn-2. L’acido stearico (18:0) è posto selettivamente nella posizione sn-1, mentre l’acido oleico (18:1) mostra la preferenza per le posizioni sn-1 e sn-3.
La posizione stereochimica è importante perché la digestione dei grassi è un sistema molto complesso che inizia già durante il transito orale per opera della lipasi orale. Questo passaggio riguarda soprattutto i prodotti a maggiore consistenza, che richiedono masticazione e quindi un tempo di contatto maggiore con la lipasi salivare, mentre per il latte il contatto è minimo.
La lipasi gastrica (o quella salivare che è acido resistente e continua quindi ad agire nello stomaco) ha maggiore affinità per il legame sn-3 per cui vengono rilasciati selettivamente e precocemente gli acidi a corta e media catena e l’acido oleico. Gli acidi grassi a corta catena vengono assorbiti precocemente a cominciare dallo stomaco, con una velocità inversamente proporzionale al numero di atomi di carbonio, entrano nel sistema portale, arrivano al fegato e sono rapidamente ossidati.
Lo stomaco è responsabile della digestione di circa il 25-40% dei trigliceridi (30). Un’altra caratteristica importante dei grassi del latte è quella di avere una grande percentuale di acido palmitico esterificato in posizione sn-2; in questo modo da una parte ne facilita l’assorbimento, poiché i 2-monogliceridi vengono più facilmente assorbiti rispetto agli acidi grassi liberi da parte degli enterociti, e, dall’altra si accorcia il tempo di clearence dei trigliceridi dopo che questi sono stati assorbiti e immessi nel sistema linfatico (46), diminuendo così la lipemia post-prandiale che è uno dei principali fattori indipendenti di rischio cardiovascolare (47). La lipemia post-prandiale infatti promuove l’infiammazione, l’insulinoresistenza, il rilascio di citochine, lo stress endoteliale e l’attivazione della coagulazione.
Quindi dalla digestione dei grassi saturi del latte, una discreta quota, quelli cioè a catena corta e media, viene rilasciata precocemente e fornisce energia per gli eterociti, per i muscoli ed altri organi tra i quali il sistema nervoso centrale, e vengono poi convertiti in calore durante i processi metabolici; pertanto non solo non pongono rischi di ipercolesterolemia o sovrappeso, ma, anzi, proteggono dal rischio di cancro del colon e della colite ulcerosa (48).
Un’altra parte di acidi grassi saturi, a più lunga catena, teoricamente ipercolesterolemizzanti, viene assorbita con facilità per il fatto che si trova in posizione sn-2 e questo comporta anche una più rapida clearence post-prandiale dei trigliceridi con abbassamento del rischio cardiovascolare.
Rischio che viene ulteriormente mitigato dalla presenza di acidi grassi a lunga catena a catena ramificata e dispari, i quali contribuiscono alla protezione cardiovascolare, da diabete mellito ed esercitano anche attività antitumorale (vedi Tabella 2).
La presenza di interessanti quantità di acidi linoleici coniugati e di alcuni acidi grassi trans tra i quali il trans-palmitoleico ed il vaccenico migliorano il metabolismo energetico e lipidico (con diminuzione della massa del tessuto adiposo), diminuisce i rischi di malattie cardiovascolari e di diabete ed insulinoresistenza ed ha effetto protettivo sulla proliferazione delle cellule tumorali (49, 50).
A ulteriore corredo, i lipidi polari del latte e gli sfingosidi esercitano un’ulteriore azione anticolesterolemica e di riduzione dei markers cardiometabolici (51, 52).
Ecco, quindi, che gli effetti dovuti alla complessa matrice del latte restituiscono un quadro completamente diverso da quello che ci si potrebbe aspettare dalla semplice composizione in acidi grassi e dalla correlazione tra quantità di grassi saturi ed aumento del rischio cardiovascolare .
CONCLUSIONI
I dati epidemiologici e le meta-analisi portano alla conclusione che, sebbene i latticini contengano un alto contenuto di acidi grassi saturi, il loro consumo ha un effetto positivo (o quanto meno neutro sulla salute cardiovascolare umana) (53-55), ma molte sono le evidenze che possano addirittura ridurre il rischio di malattie cardiovascolari e diabete (56, 57), migliorare la salute intestinale e la prevenzione di infiammazione e tumori.
I meccanismi attraverso i quali si esercita questa protezione non sono ancora del tutto chiari e sono state proposte diverse ipotesi tra le quali l’effetto dovuto alla complessità della struttura della matrice lattiero casearia (58).
Il consumo di latticini interi oltre ad essere più palatabile, contribuisce inoltre a maggiori assunzioni di nutrienti significativi, in particolare vitamina D e vitamina K.
Considerando le attuali evidenze scientifiche quindi è necessario informare correttamente i consumatori affinché l’immagine negativa del grasso del latte perda sempre più consistenza e che almeno coloro esenti da ipercolesterolemia, in via prudenziale, comincino a consumare, magari moderatamente, prodotti interi inseriti in uno stile di vita sano ed equilibrato, che ponga particolare attenzione alle altre fonti di grassi della dieta.
Come già evidenziato nel numero 95 de Lattendibile (ottobre 2022), occorrerebbe spostare l’attenzione e l’enfasi non tanto sui livelli di grassi saturi e colesterolo quanto sui biomarcatori infiammatori per chiarire i meccanismi cardioprotettivi dei prodotti lattiero caseari.
A cura di: Prof. Andrea Ghiselli, Direttore del Master di I livello in Scienza dell’Alimentazione e Dietetica Applicata, Unitelma Sapienza, Roma.
1. Keys, A., Coronary heart disease in seven countries. 1970. Nutrition, 1997. 13(3): p. 250-2; discussion 249, 253.
2. Eilander, A., R.K. Harika, and P.L. Zock, Intake and sources of dietary fatty acids in Europe: Are current population intakes of fats aligned with dietary recommendations? Eur J Lipid Sci Technol, 2015. 117(9): p. 1370-1377.
3. Nutrition and diet for healthy lifestyles in Europe: science and policy implications. Public Health Nutrition, 2001. 4(2a): p. 265-273.
4. USDA. Dietary Guidelines for Americans. 1980; Available from: https://www.dietaryguidelines.gov/about-dietary-guidelines/previous-editions/1980-dietary-guidelines-americans.
5. USDA. Dietary Guidelines for Americans. 1985; Available from: https://ww.dietaryguidelines.gov/about-dietary-guidelines/previous-editions/1985-dietary-guidelines-americans.
6. USDA. Dietary Guidelines for Americans. 1990; Available from: https:// ww.dietaryguidelines.gov/about-dietary-guidelines/previous-editions/1990-dietary-guidelines-americans.
7. USDA. Dietary Guidelines for Americans. 1995; Available from: https:// ww.dietaryguidelines.gov/about-dietary-guidelines/previous-editions/1995-dietary-guidelines.
8. LARN, Livelli di Assunzione di Riferimento di Nutrienti ed Energia per la popolazione italiana. 2014: SINU.
9. CREA – Centro di ricerca Alimenti e la nutrizione. Linee Guida per una sana alimentazione.
10. U.S. Department of Agriculture and U.S. Department of Health and Human Services. Dietary Guidelines for Americans, 2020-2025.
11. Mullie, P., C. Pizot, and P. Autier, Daily milk consumption and all-cause mortality, coronary heart disease and stroke: a systematic review and meta-analysis of observational cohort studies. BMC Public Health, 2016. 16(1): p. 1236.
12. Hu, D., et al., Dairy foods and risk of stroke: A meta-analysis of prospective cohort studies. Nutrition, Metabolism and Cardiovascular Diseases, 2014. 24(5): p. 460-469.
13. Patterson, E., et al., Association between Dairy Food Consumption and Risk of Myocardial Infarction in Women Differs by Type of Dairy Food. The Journal of Nutrition, 2013. 143(1): p. 74-79.
14. Drouin-Chartier, J.-P., et al., Systematic Review of the Association between Dairy Product Consumption and Risk of Cardiovascular-Related Clinical Outcomes. Advances in Nutrition, 2016. 7(6): p. 1026-1040.
15. Kratz, M., T. Baars, and S. Guyenet, The relationship between high-fat dairy consumption and obesity, cardiovascular, and metabolic disease. European Journal of Nutrition, 2013. 52(1): p. 1-24.
16. Mozaffarian, D., et al., Changes in Diet and Lifestyle and Long-Term Weight Gain in Women and Men. New England Journal of Medicine, 2011. 364(25): p. 2392-2404.
17. Rautiainen, S., et al., Dairy consumption in association with weight change and risk of becoming overweight or obese in middle-aged and older women: a prospective cohort study1, 2, 3. The American Journal of Clinical Nutrition, 2016. 103(4): p. 979-988.
18. Chen, M., et al., Dairy consumption and risk of type 2 diabetes: 3 cohorts of US adults and an updated meta-analysis. BMC Medicine, 2014. 12(1): p. 215.
19. Imamura, F., et al., Fatty acid biomarkers of dairy fat consumption and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLOS Medicine, 2018. 15(10): p. e1002670.
20. de Souza, R.J., et al., Intake of saturated and trans unsaturated fatty acids and risk of all cause mortality, cardiovascular disease, and type 2 diabetes: systematic review and meta-analysis of observational studies. BMJ : British Medical Journal, 2015. 351: p. h3978.
21. Aune, D., et al., Dairy products and the risk of type 2 diabetes: a systematic review and dose-response meta-analysis of cohort studies1,2,3. The American Journal of Clinical Nutrition, 2013. 98(4): p. 1066-1083.
22. Appel, L.J., et al., A clinical trial of the effects of dietary patterns on blood pressure. DASH Collaborative Research Group. N Engl J Med, 1997. 336(16): p. 1117-24.
23. Chiu, S., et al., Comparison of the DASH (Dietary Approaches to Stop Hypertension) diet and a higher-fat DASH diet on blood pressure and lipids and lipoproteins: a randomized controlled trial1, 2, 3. The American Journal of Clinical Nutrition, 2016. 103(2): p. 341-347.
24. Hess, J.M., C.J. Cifelli, and V.L. Fulgoni, 3rd, Modeling the Impact of Fat Flexibility With Dairy Food Servings in the 2015-2020 Dietary Guidelines for Americans Healthy U.S.-Style Eating Pattern. Front Nutr, 2020. 7: p. 595880.
25. Scrafford, C.G., et al., Health Care Costs and Savings Associated with Increased Dairy Consumption among Adults in the United States. Nutrients, 2020. 12(1).
26. National Dairy Council. NHANES 2011-2014. 2018; Available from: https://www.usdairy.com/science-and-research/dairys-role-in-the-diet.
27. EFSA. The EFSA Comprehensive European Food Consumption Database. 2022; Available from: https://www.efsa.europa.eu/it/microstrategy/foodex2-level-7.
28. Hamdy, O., et al., CHAPTER 2. Clinical nutrition guideline for overweight and obese adults with type 2 diabetes (T2D) or prediabetes, or those at high risk for developing T2D. Am J Manag Care, 2018. 24(7 Spec No.): p. Sp226-sp231.
29. National Heart Foundation of Australia. Heart Healthy Eating Patterns. 2019; Available from: https://www.heartfoundation.org.au/images/uploads/main/Nutrition_Position_Statement_-_HHEP_FINAL-3.pdf.
30. Månsson, H.L., Fatty acids in bovine milk fat. Food Nutr Res, 2008. 52.
31. Parodi, P.W., Cows’ milk fat components as potential anticarcinogenic agents. J Nutr, 1997. 127(6): p. 1055-60.
32. Pfeuffer, M. and J. Schrezenmeir, Bioactive substances in milk with properties decreasing risk of cardiovascular diseases. Br J Nutr, 2000. 84 Suppl 1: p. S155-9.
33. Lee, K.W., et al., Role of the conjugated linoleic acid in the prevention of cancer. Crit Rev Food Sci Nutr, 2005. 45(2): p. 135-44.
34. Valeille, K., et al., The natural concentration of the conjugated linoleic acid, cis-9,trans-11, in milk fat has antiatherogenic effects in hyperlipidemic hamsters. J Nutr, 2006. 136(5): p. 1305-10.
35. Hanuš, O., et al., Role of Fatty Acids in Milk Fat and the Influence of Selected Factors on Their Variability-A Review. Molecules, 2018. 23(7).
36. Mu, H. and C.-E. Høy, The digestion of dietary triacylglycerols. Progress in Lipid Research, 2004. 43(2): p. 105-133.
37. Jensen, R. and D. Newberg, Bovine milk lipids. Handbook of milk composition. Handbook of Milk Composition, 1995. 85(2): p. 295-350.
38. Parodi, P.W., Milk fat in human nutrition. Australian Journal of Dairy Technology, 2004. 59(1): p. 3.
39. Jensen, R.G., The composition of bovine milk lipids: January 1995 to December 2000. Journal of dairy science, 2002. 85(2): p. 295-350.
40. Singh, H., Symposium review: Fat globules in milk and their structural modifications during gastrointestinal digestion. J Dairy Sci, 2019. 102(3): p. 2749-2759.
41. Chai, C., S. Oh, and J.Y. Imm, Roles of Milk Fat Globule Membrane on Fat Digestion and Infant Nutrition. Food Sci Anim Resour, 2022. 42(3): p. 351-371.
42. Anto, L., et al., Milk Polar Lipids: Underappreciated Lipids with Emerging Health Benefits. Nutrients, 2020. 12(4): p. 1001.
43. Norris, G.H., et al., Protective properties of milk sphingomyelin against dysfunctional lipid metabolism, gut dysbiosis, and inflammation. J Nutr Biochem, 2019. 73: p. 108224.
44. Millar, C.L., et al., Cow’s milk polar lipids reduce atherogenic lipoprotein cholesterol, modulate gut microbiota and attenuate atherosclerosis development in LDL-receptor knockout mice fed a Western-type diet. The Journal of Nutritional Biochemistry, 2020. 79: p. 108351.
45. Vors, C., et al., Milk polar lipids reduce lipid cardiovascular risk factors in overweight postmenopausal women: towards a gut sphingomyelin-cholesterol interplay. Gut, 2020. 69(3): p. 487-501.
46. Sanders, T.A., et al., Palmitic acid in the sn-2 position of triacylglycerols acutely influences postprandial lipid metabolism. Am J Clin Nutr, 2011. 94(6): p. 1433-41.
47. Vors, C., et al., Dietary lipids and cardiometabolic health: a new vision of structure-activity relationship. Curr Opin Clin Nutr Metab Care, 2020. 23(6): p. 451-459.
48. Miciński, J., et al., The effects of bovine milk fat on human health. Polish Annals of Medicine, 2012. 19(2): p. 170-175.
49. Lehnen, T.E., et al., A review on effects of conjugated linoleic fatty acid (CLA) upon body composition and energetic metabolism. Journal of the International Society of Sports Nutrition, 2015. 12(1): p. 36.
50. Risérus, U., et al., Metabolic effects of conjugated linoleic acid in humans: the Swedish experience. The American Journal of Clinical Nutrition, 2004. 79(6): p. 1146S-1148S.
51. Norris, G.H., et al., Dietary Milk Sphingomyelin Reduces Systemic Inflammation in Diet-Induced Obese Mice and Inhibits LPS Activity in Macrophages. Beverages, 2017. 3(3): p. 37.
52. Vors, C., et al., Milk polar lipids reduce lipid cardiovascular risk factors in overweight postmenopausal women: towards a gut sphingomyelin-cholesterol interplay. Gut, 2020. 69(3): p. 487-501.
53. Qin, L.Q., et al., Dairy consumption and risk of cardiovascular disease: an updated meta-analysis of prospective cohort studies. Asia Pac J Clin Nutr, 2015. 24(1): p. 90-100.
54. Alexander, D.D., et al., Dairy consumption and CVD: a systematic review and meta-analysis. British Journal of Nutrition, 2016. 115(4): p. 737-750.
55. Astrup, A., Yogurt and dairy product consumption to prevent cardiometabolic diseases: epidemiologic and experimental studies1,2,3. The American Journal of Clinical Nutrition, 2014. 99(5): p. 1235S-1242S.
56. Astrup, A., et al., Saturated Fats and Health: A Reassessment and Proposal for Food-Based Recommendations: JACC State-of-the-Art Review. Journal of the American College of Cardiology, 2020. 76(7): p. 844-857.
57. Guo, J., et al., The Impact of Dairy Products in the Development of Type 2 Diabetes: Where Does the Evidence Stand in 2019? Adv Nutr, 2019. 10(6): p. 1066-1075.
58. Mozaffarian, D., Dairy foods, dairy fat, diabetes, and death: what can be learned from 3 large new investigations? Am J Clin Nutr, 2019. 110(5): p. 1053-1054.